文献分享:J. Am. Chem. Soc.|基于巨噬细胞搭便车的多功能肽核酸/肽共聚物双模式生物传感器用于增强肿瘤成像和尿液分析
来源:
西安纳微生物科技有限公司 日期:02-25 274 属于:行业动态
2024年11月20日,湖南大学化学化工学院的楚霞教授和陈婷婷副教授团队在著名期刊《Journal of the American Chemical Society》上发布,IF=15.7,发表题目为“A Multifunctional Peptide Nucleic Acid/Peptide Copolymer-Based Dual-Mode Biosensor with Macrophage-Hitchhiking for Enhanced Tumor Imaging and Urinalysis”。该文章主要阐述了通过构建了一个基于多功能肽核酸(PNA)/肽共聚物和DNA四面体的双模式生物传感器,利用巨噬细胞能够主动将生物传感器传递到肿瘤部位,并通过增强生物传感器与肿瘤相关生物标志物或癌细胞之间的相互作用,显著提高信号输出,用于肿瘤成像和尿液分析。
 随着人们对身体健康认知的提高,癌症早期检测已经备受大家追捧和关注。具相关报道,约50%的癌症患者是在晚期被诊断出来,这大大降低患者的生存率。肿瘤的发生和进展可以通过内源性生物标志物检测,如循环肿瘤DNA、血液、其他生物液体中的蛋白质。但是生物标志物的表达或释放取决于患者的差异和肿瘤的异质性,以及受到血液稀释的影响,这给早期癌症检测增加难度。为了解决这一问题,合成生物标记物成为一种具有很大前途的无创早期诊断方法。
随着人们对身体健康认知的提高,癌症早期检测已经备受大家追捧和关注。具相关报道,约50%的癌症患者是在晚期被诊断出来,这大大降低患者的生存率。肿瘤的发生和进展可以通过内源性生物标志物检测,如循环肿瘤DNA、血液、其他生物液体中的蛋白质。但是生物标志物的表达或释放取决于患者的差异和肿瘤的异质性,以及受到血液稀释的影响,这给早期癌症检测增加难度。为了解决这一问题,合成生物标记物成为一种具有很大前途的无创早期诊断方法。
在肿瘤微环境中,生物传感器选择性地响应局部肿瘤相关的生物标志物,并产生报告基因,如多肽、核酸等。这些报告基因被称为合成生物标记物,可以在生物液体中快速和容易地检测到。到目前为止,各种生物传感器已经被引入,其中,通过蛋白酶裂解纳米复合材料传感器产生的肽基合成生物标志物取得了显著进展。然而,以肽为基础的生物标志物必须严格设计,以避免血液中蛋白酶的非特异性切割,这使方案复杂化。此外,基于体内传感器的策略面临着实现病理部位有效积累的困境。
这些传感器通常通过增强的渗透和保留效应,被动地靶向并积累在肿瘤部位。然而,通过这种方法的传递效率通常是有限的,传感器通常停留在肿瘤组织的边缘,难以穿透到肿瘤的深度,导致信号输出有限,灵敏度低。近年来,有报道称,循环细胞,包括中性粒细胞、单核细胞和巨噬细胞,有自然迁移到病理部位的能力。这一固有的特性可以用于“细胞便车”(cellular hitchhiking),实现有效载荷。特别是巨噬细胞,作为一个肿瘤中大量存在的细胞,能够主动地归巢到肿瘤部位并浸润到肿瘤中。
受这一特性的启发,质粒工程巨噬细胞和巨噬细胞背包等策略已被广泛接受,以增强治疗药物的递送。然而,利用巨噬细胞主动将生物传感器递送到肿瘤部位的可行性以及对早期癌症诊断检测灵敏度的影响仍未探索。
摘要:
生物传感器能够通过体内或液体活检成像来诊断肿瘤,但它们面临着进入肿瘤部位效率低下和缺乏可靠的肿瘤相关生物标志物的挑战。在此,我们构建了一个基于多功能肽核酸(PNA)/肽共聚物和DNA四面体的双模式生物传感器,用于肿瘤成像和尿液分析。
该生物传感器可在肿瘤微环境中被基质金属蛋白酶(matrix-metalloprotease, MMP)裂解后进入癌细胞,启动microrna -21特异性的催化发夹组装反应,MMP裂解产物被释放到血液中,然后被肾脏过滤掉。
由于PNA是一种合成的DNA类似物,不能被核酸酶和蛋白酶降解,因此它可以作为一种可靠的合成生物标志物,并且易于通过高效液相色谱法在尿液中检测到。
重要的是,该生物传感器被安装在巨噬细胞膜上,利用巨噬细胞主动归巢到肿瘤部位并浸润到肿瘤内部的能力,实现了在肿瘤深处的高效递送。结果表明,该生物传感器的信号输出明显改善,肿瘤体积小至30-40 mm3的小鼠可通过尿液检测可靠地鉴别。
这种创新的巨噬细胞携带双模式生物传感器是一种很有潜力的非侵入性和方便的工具,用于肿瘤诊断和肿瘤进展评估。
本文作者团队开发一种基于肽-核酸的组装体,能够锚定在巨噬细胞表面,通过适配体介导的癌细胞内吞与细胞内的miRNA反应并成像。
首先,将4个单链DNA(TD)组装成一个含有AS1411适配体的DNA四面体,通过杂交(TDH)将两个DNA发夹(H1和H2)偶联在TD的顶点上,形成TDHP。
之后,研究者设计制备多片段核酸(PNA)/肽共聚物(PNA-peptide-PNA-PEG2000-DSPE,简称4PD),通过H1发夹与PNA(TDHP)杂交,将亚稳态发夹H1锁定在四面体上。PNA是一种DNA模拟物,由于其对DNA链的高亲和力,已被用于各种DNA操作工具。此外,PNA/肽共聚物已被用于制造体内应用的各种装置。
后通过DSPE(MTDHP)将生物传感器TDHP固定在巨噬细胞膜上(方案图1a,b)。静脉注射全身给药后,携带生物传感器的噬细胞在肿瘤细胞因子和趋势化因子的作用下积极迁移并浸润到肿瘤部位(图1c)。在肿瘤微环境(TME)中,局部上调的基质金属蛋白酶(MMP)特异性地切割TDHP 4PD中的肽底物,从巨噬细胞中释放TDH复合物。
解离的TDH通过AS1411适配体介导的内吞作用被内化到肿瘤细胞中。肿瘤细胞中高表达的microRNA-21启动了H1和H2发夹之间的局部催化发夹组装(CHA)反应,导致荧光恢复。CHA反应只有在蛋白酶和miRNA同时存在的情况下才会被激活,这种“双锁”串联设计保证了体内肿瘤成像的高特异性。同时,裂解的PNA/多肽残基(约3.2 nm)被释放到血液中,并被肾脏过滤(<5 nm),可以作为一种合成生物标志物,并且可以通过高效液相色谱(HPLC)分析在尿液中快速而容易地检测到,从而实现对癌症进展的无创监测。
重要的是,由于PNA既不是肽也不是核酸,它赋予PNA抵抗蛋白酶或核酸酶的韧性,使其成为比纯肽基的PNA更好的候选者。
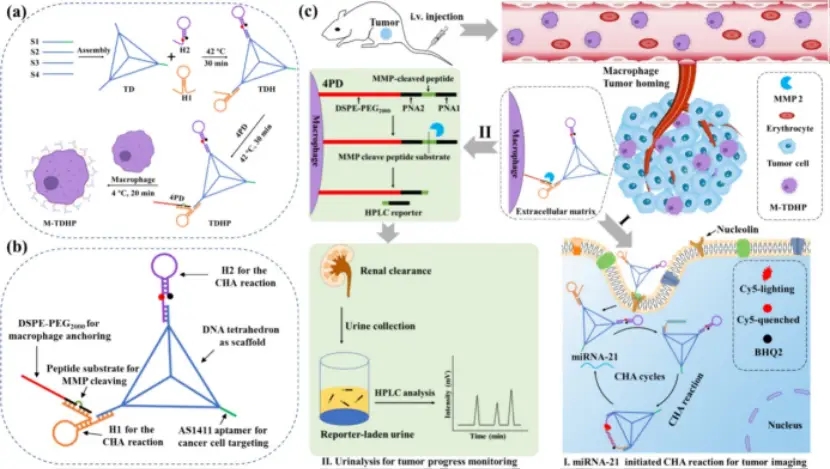
图1 巨噬细胞便车负载双模生物传感器的制备及相关作用机制
研究团队构建单链DNA组装四面体TD,通过DLS确定组装体的粒径大约27 nm。Cy5被连接在H2发夹结构上,通过荧光共聚焦显微镜确定TDHP可以被锚定在巨噬细胞表面,与细胞膜染色剂Dil有良好的共定位。证明纳米组装体具有良好的巨噬细胞锚定功能。(图2)
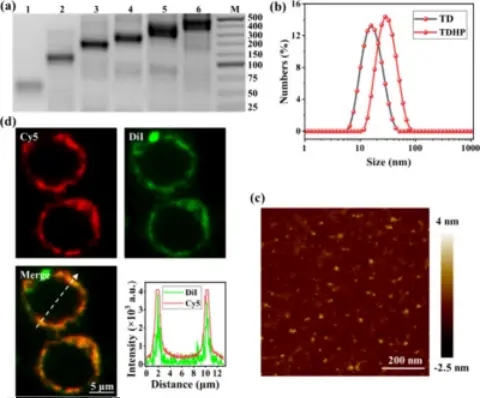
图2. TDHP生物传感器的基本性质及巨噬细胞膜定位特征
接着,在体外验证TDHP响应MMP和miRNA-21的能力。在H2发夹结构上,当Cy5和其淬灭剂被配对一起时,没有荧光发射。当H1和H2由于miRNA-21介导的反应杂交后,荧光会被释放。从荧光发射光谱中,反映出TDHP只有在miRNA-21和MMP共同存在的条件下、TDH只有在miRNA-21存在的条件下才会发射荧光。通过HPLC分析也能够发现代表MMP酶切产物4PD的峰,随着MMP浓度的增加而增高,代表着4PD的完全释放。(图3)
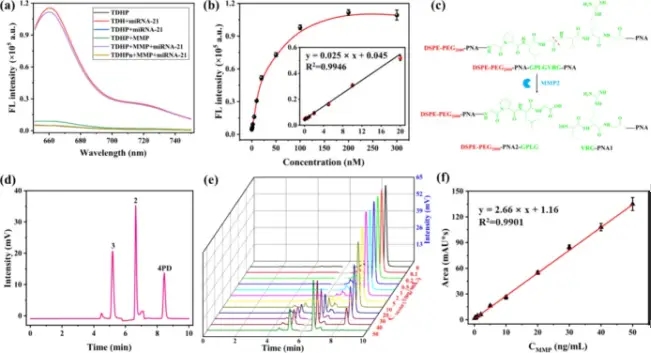
图3. TDHP生物传感器的体外MMP响应和miRNA-21响应性能
在4T1肿瘤细胞中验证TDHP的响应成像能力。被癌细胞摄取之后,TDH1-2处理的细胞显示出了强烈的Cy5荧光,大约是没有H1和H2发夹结构处理细胞的20倍以上。在较高浓度MMP处理下,TPHD也会在癌细胞中显现较强的Cy5荧光,反映其纳米结构响应MMP和肿瘤特异性miRNA-21的能力。(图4)
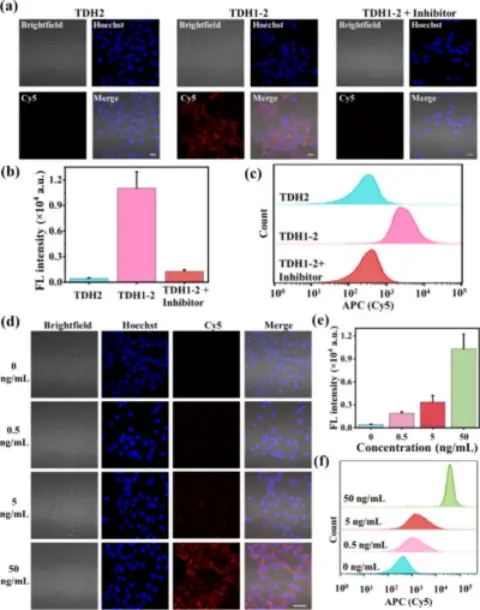
图4. TDHP生物传感器在4T1细胞中响应性成像性能
在研究了TDHP纳米组装体在体内肿瘤成像的能力。体内生物分布研究表明,被巨噬细胞搭载的M-TDHP会由于肿瘤细胞分泌的各类趋化因子而主要积累在肝脏和肿瘤部位。巨噬细胞搭载后也能显著延长TDHP在体内的滞留时间。独立的TDHP只能在肿瘤组织边缘停留,而M-TDHP可以深入组织内部,表明巨噬细胞确实可以帮助TDHP在肿瘤中的积累和渗透。在荷瘤小鼠中,M-TDHP能在静脉注射12 h后在肿瘤区域内显示出强烈的荧光,而添加MMP抑制剂后,荧光则会大幅度减弱,证明了拥有M-TDHP肿瘤响应性的生物成像能力。(图5)
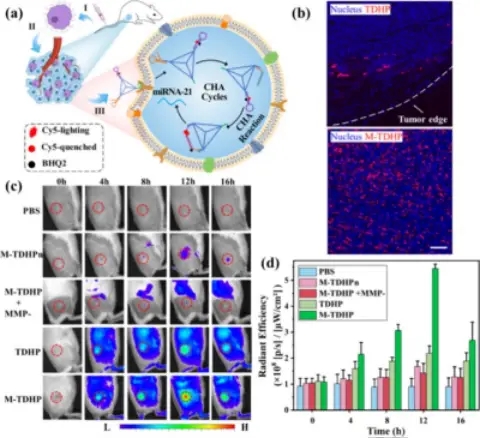
图5. 巨噬细胞“搭便车”生物传感器(M-TDHP)的体内肿瘤特异性成像
由于PNA是一种合成的DNA类似物,不能被血液中的核酸酶和蛋白酶降解,因此它具有良好的稳定性。且MMP切割产物的尺寸小于5 nm,被肾脏过滤排出,因此可以作为尿液标志物用于肿瘤早筛。在动物实验中,荷瘤小鼠的尿液中M-TDHP比未经巨噬细胞“搭便车”的TDHP高11.2倍,展现出良好的特异性和响应性。作者团队还初步检测了此方法能够检测的肿瘤小体积,发现在肿瘤体积30-40 mm3时,尿液中的PNA含量已经能做到较高的响应率,AUC = 1,证明生物传感器可以可靠地区分肿瘤体积小至30−40mm3的小鼠。(图6)
.png)
图6. 对小鼠尿液中的酶切PNA产物HPLC分析以实现肿瘤早筛
结论:
在这项工作中,作者开发了一种基于PNA/肽共聚物的多功能双模式生物传感器,用于增强肿瘤成像和尿液分析。该生物传感器可在肿瘤微环境中经MMP切割后进入癌细胞,启动miRNA-21特异性CHA反应,这种“双锁”串联设计提供了高特异性的体内肿瘤成像。此外,MMP裂解产物VRG-PNA1被释放到血液中,然后被肾脏过滤,并随尿液排出。
由于PNA是一种合成的DNA类似物,不能被血液中的核酸酶和蛋白酶降解,因此它可以作为一种理想的合成生物标志物,并且易于HPLC检测,从而通过方便的尿液分析来评估肿瘤的进展。更重要的是,首次将生物传感器搭便车到巨噬细胞膜上,以实现生物传感器的高效递送。通过增强生物传感器与肿瘤相关生物标志物或癌细胞之间的相互作用,这种巨噬细胞搭便车策略可以有效地将生物传感器传递到肿瘤深处,从而显著改善信号输出。
结果表明,当生物传感器搭载在巨噬细胞上时,高效液相色谱尿液检测和体内肿瘤成像的信号输出分别提高了约11.2倍和2.5倍,并且肿瘤体积小至30-40 mm3的小鼠可以通过尿液检测可靠地识别。作者预计这种创新的巨噬细胞搭便车双模生物传感器作为一种非侵入性和方便的肿瘤诊断和肿瘤进展评估工具具有巨大的潜力。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除。
 随着人们对身体健康认知的提高,癌症早期检测已经备受大家追捧和关注。具相关报道,约50%的癌症患者是在晚期被诊断出来,这大大降低患者的生存率。肿瘤的发生和进展可以通过内源性生物标志物检测,如循环肿瘤DNA、血液、其他生物液体中的蛋白质。但是生物标志物的表达或释放取决于患者的差异和肿瘤的异质性,以及受到血液稀释的影响,这给早期癌症检测增加难度。为了解决这一问题,合成生物标记物成为一种具有很大前途的无创早期诊断方法。
随着人们对身体健康认知的提高,癌症早期检测已经备受大家追捧和关注。具相关报道,约50%的癌症患者是在晚期被诊断出来,这大大降低患者的生存率。肿瘤的发生和进展可以通过内源性生物标志物检测,如循环肿瘤DNA、血液、其他生物液体中的蛋白质。但是生物标志物的表达或释放取决于患者的差异和肿瘤的异质性,以及受到血液稀释的影响,这给早期癌症检测增加难度。为了解决这一问题,合成生物标记物成为一种具有很大前途的无创早期诊断方法。在肿瘤微环境中,生物传感器选择性地响应局部肿瘤相关的生物标志物,并产生报告基因,如多肽、核酸等。这些报告基因被称为合成生物标记物,可以在生物液体中快速和容易地检测到。到目前为止,各种生物传感器已经被引入,其中,通过蛋白酶裂解纳米复合材料传感器产生的肽基合成生物标志物取得了显著进展。然而,以肽为基础的生物标志物必须严格设计,以避免血液中蛋白酶的非特异性切割,这使方案复杂化。此外,基于体内传感器的策略面临着实现病理部位有效积累的困境。
这些传感器通常通过增强的渗透和保留效应,被动地靶向并积累在肿瘤部位。然而,通过这种方法的传递效率通常是有限的,传感器通常停留在肿瘤组织的边缘,难以穿透到肿瘤的深度,导致信号输出有限,灵敏度低。近年来,有报道称,循环细胞,包括中性粒细胞、单核细胞和巨噬细胞,有自然迁移到病理部位的能力。这一固有的特性可以用于“细胞便车”(cellular hitchhiking),实现有效载荷。特别是巨噬细胞,作为一个肿瘤中大量存在的细胞,能够主动地归巢到肿瘤部位并浸润到肿瘤中。
受这一特性的启发,质粒工程巨噬细胞和巨噬细胞背包等策略已被广泛接受,以增强治疗药物的递送。然而,利用巨噬细胞主动将生物传感器递送到肿瘤部位的可行性以及对早期癌症诊断检测灵敏度的影响仍未探索。
摘要:
生物传感器能够通过体内或液体活检成像来诊断肿瘤,但它们面临着进入肿瘤部位效率低下和缺乏可靠的肿瘤相关生物标志物的挑战。在此,我们构建了一个基于多功能肽核酸(PNA)/肽共聚物和DNA四面体的双模式生物传感器,用于肿瘤成像和尿液分析。
该生物传感器可在肿瘤微环境中被基质金属蛋白酶(matrix-metalloprotease, MMP)裂解后进入癌细胞,启动microrna -21特异性的催化发夹组装反应,MMP裂解产物被释放到血液中,然后被肾脏过滤掉。
由于PNA是一种合成的DNA类似物,不能被核酸酶和蛋白酶降解,因此它可以作为一种可靠的合成生物标志物,并且易于通过高效液相色谱法在尿液中检测到。
重要的是,该生物传感器被安装在巨噬细胞膜上,利用巨噬细胞主动归巢到肿瘤部位并浸润到肿瘤内部的能力,实现了在肿瘤深处的高效递送。结果表明,该生物传感器的信号输出明显改善,肿瘤体积小至30-40 mm3的小鼠可通过尿液检测可靠地鉴别。
这种创新的巨噬细胞携带双模式生物传感器是一种很有潜力的非侵入性和方便的工具,用于肿瘤诊断和肿瘤进展评估。
本文作者团队开发一种基于肽-核酸的组装体,能够锚定在巨噬细胞表面,通过适配体介导的癌细胞内吞与细胞内的miRNA反应并成像。
首先,将4个单链DNA(TD)组装成一个含有AS1411适配体的DNA四面体,通过杂交(TDH)将两个DNA发夹(H1和H2)偶联在TD的顶点上,形成TDHP。
之后,研究者设计制备多片段核酸(PNA)/肽共聚物(PNA-peptide-PNA-PEG2000-DSPE,简称4PD),通过H1发夹与PNA(TDHP)杂交,将亚稳态发夹H1锁定在四面体上。PNA是一种DNA模拟物,由于其对DNA链的高亲和力,已被用于各种DNA操作工具。此外,PNA/肽共聚物已被用于制造体内应用的各种装置。
后通过DSPE(MTDHP)将生物传感器TDHP固定在巨噬细胞膜上(方案图1a,b)。静脉注射全身给药后,携带生物传感器的噬细胞在肿瘤细胞因子和趋势化因子的作用下积极迁移并浸润到肿瘤部位(图1c)。在肿瘤微环境(TME)中,局部上调的基质金属蛋白酶(MMP)特异性地切割TDHP 4PD中的肽底物,从巨噬细胞中释放TDH复合物。
解离的TDH通过AS1411适配体介导的内吞作用被内化到肿瘤细胞中。肿瘤细胞中高表达的microRNA-21启动了H1和H2发夹之间的局部催化发夹组装(CHA)反应,导致荧光恢复。CHA反应只有在蛋白酶和miRNA同时存在的情况下才会被激活,这种“双锁”串联设计保证了体内肿瘤成像的高特异性。同时,裂解的PNA/多肽残基(约3.2 nm)被释放到血液中,并被肾脏过滤(<5 nm),可以作为一种合成生物标志物,并且可以通过高效液相色谱(HPLC)分析在尿液中快速而容易地检测到,从而实现对癌症进展的无创监测。
重要的是,由于PNA既不是肽也不是核酸,它赋予PNA抵抗蛋白酶或核酸酶的韧性,使其成为比纯肽基的PNA更好的候选者。

图1 巨噬细胞便车负载双模生物传感器的制备及相关作用机制
研究团队构建单链DNA组装四面体TD,通过DLS确定组装体的粒径大约27 nm。Cy5被连接在H2发夹结构上,通过荧光共聚焦显微镜确定TDHP可以被锚定在巨噬细胞表面,与细胞膜染色剂Dil有良好的共定位。证明纳米组装体具有良好的巨噬细胞锚定功能。(图2)

图2. TDHP生物传感器的基本性质及巨噬细胞膜定位特征
接着,在体外验证TDHP响应MMP和miRNA-21的能力。在H2发夹结构上,当Cy5和其淬灭剂被配对一起时,没有荧光发射。当H1和H2由于miRNA-21介导的反应杂交后,荧光会被释放。从荧光发射光谱中,反映出TDHP只有在miRNA-21和MMP共同存在的条件下、TDH只有在miRNA-21存在的条件下才会发射荧光。通过HPLC分析也能够发现代表MMP酶切产物4PD的峰,随着MMP浓度的增加而增高,代表着4PD的完全释放。(图3)

图3. TDHP生物传感器的体外MMP响应和miRNA-21响应性能
在4T1肿瘤细胞中验证TDHP的响应成像能力。被癌细胞摄取之后,TDH1-2处理的细胞显示出了强烈的Cy5荧光,大约是没有H1和H2发夹结构处理细胞的20倍以上。在较高浓度MMP处理下,TPHD也会在癌细胞中显现较强的Cy5荧光,反映其纳米结构响应MMP和肿瘤特异性miRNA-21的能力。(图4)

图4. TDHP生物传感器在4T1细胞中响应性成像性能
在研究了TDHP纳米组装体在体内肿瘤成像的能力。体内生物分布研究表明,被巨噬细胞搭载的M-TDHP会由于肿瘤细胞分泌的各类趋化因子而主要积累在肝脏和肿瘤部位。巨噬细胞搭载后也能显著延长TDHP在体内的滞留时间。独立的TDHP只能在肿瘤组织边缘停留,而M-TDHP可以深入组织内部,表明巨噬细胞确实可以帮助TDHP在肿瘤中的积累和渗透。在荷瘤小鼠中,M-TDHP能在静脉注射12 h后在肿瘤区域内显示出强烈的荧光,而添加MMP抑制剂后,荧光则会大幅度减弱,证明了拥有M-TDHP肿瘤响应性的生物成像能力。(图5)

图5. 巨噬细胞“搭便车”生物传感器(M-TDHP)的体内肿瘤特异性成像
由于PNA是一种合成的DNA类似物,不能被血液中的核酸酶和蛋白酶降解,因此它具有良好的稳定性。且MMP切割产物的尺寸小于5 nm,被肾脏过滤排出,因此可以作为尿液标志物用于肿瘤早筛。在动物实验中,荷瘤小鼠的尿液中M-TDHP比未经巨噬细胞“搭便车”的TDHP高11.2倍,展现出良好的特异性和响应性。作者团队还初步检测了此方法能够检测的肿瘤小体积,发现在肿瘤体积30-40 mm3时,尿液中的PNA含量已经能做到较高的响应率,AUC = 1,证明生物传感器可以可靠地区分肿瘤体积小至30−40mm3的小鼠。(图6)
.png)
图6. 对小鼠尿液中的酶切PNA产物HPLC分析以实现肿瘤早筛
结论:
在这项工作中,作者开发了一种基于PNA/肽共聚物的多功能双模式生物传感器,用于增强肿瘤成像和尿液分析。该生物传感器可在肿瘤微环境中经MMP切割后进入癌细胞,启动miRNA-21特异性CHA反应,这种“双锁”串联设计提供了高特异性的体内肿瘤成像。此外,MMP裂解产物VRG-PNA1被释放到血液中,然后被肾脏过滤,并随尿液排出。
由于PNA是一种合成的DNA类似物,不能被血液中的核酸酶和蛋白酶降解,因此它可以作为一种理想的合成生物标志物,并且易于HPLC检测,从而通过方便的尿液分析来评估肿瘤的进展。更重要的是,首次将生物传感器搭便车到巨噬细胞膜上,以实现生物传感器的高效递送。通过增强生物传感器与肿瘤相关生物标志物或癌细胞之间的相互作用,这种巨噬细胞搭便车策略可以有效地将生物传感器传递到肿瘤深处,从而显著改善信号输出。
结果表明,当生物传感器搭载在巨噬细胞上时,高效液相色谱尿液检测和体内肿瘤成像的信号输出分别提高了约11.2倍和2.5倍,并且肿瘤体积小至30-40 mm3的小鼠可以通过尿液检测可靠地识别。作者预计这种创新的巨噬细胞搭便车双模生物传感器作为一种非侵入性和方便的肿瘤诊断和肿瘤进展评估工具具有巨大的潜力。
免责声明:本文为行业交流学习,版权归原作者所有,如有侵权,可联系删除。


